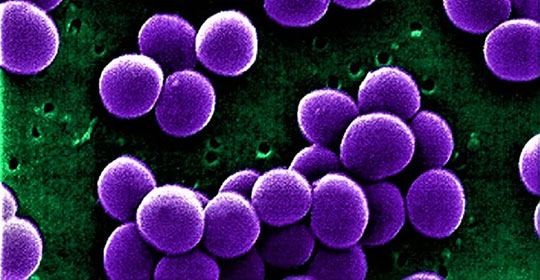
Aptorum Group, società biofarmaceutica specializzata nello sviluppo di tecnologie innovative per il trattamento di una gamma di patologie comprese malattie infettive, ha annunciato che tramite la sua affiliata Aptorum International Limited, ha presentato alla Public Health Agency of Canada, l’agenzia canadese del farmaco, una richiesta di autorizzazione a condurre uno studio clinico di fase 1 su ALS-4, un farmaco a piccole molecole a somministrazione orale per il trattamento di infezioni causate da Staphylococcus aureus compreso lo Staphylococcus aureus resistente alla meticillina (MRSA), concepito per testare la sicurezza, tollerabilità e farmacocinetica di ALS-4 in volontari sani.
Lo studio
Il dottor Clark Cheng, Direttore sanitario e Direttore generale di Aptorum Group, ha così commentato: “Facendo seguito al nostro ultimo aggiornamento nel settembre 2020, siamo lieti di annunciare la presentazione di questa CTA, che rappresenta una pietra miliare nello sviluppo del nostro programma antibatterico basato su ALS-4, una nuova piccola molecola che permette di adottare un approccio anti-virulento (non antibiotico) per affrontare le crescenti esigenze mediche non soddisfatte di infezioni causate da Staphylococcus aureus. ALS-4 è un farmaco a somministrazione orale e pertanto si allinea alla politica sanitaria globale finalizzata a promuovere attivamente il passaggio da una terapia antimicrobica endovenosa ad una orale. Come dimostrato dai nostri dati preclinici interni e subordinatamente a ulteriori studi clinici, ALS-4 è potenzialmente utilizzabile in monoterapia o in associazione con antibiotici esistenti (ad esempio, vancomicina) con l’obiettivo di ridurre la mortalità e la morbilità dei pazienti infetti, particolarmente in casi gravi. Riteniamo che il nostro farmaco ALS-4 a somministrazione orale possa anche affrontare un’ampia gamma di infezioni causate da Staphylococcus aureus, compresi (ma non in via limitativa) la batteriemia da MRSA e le infezioni cutanee e dei tessuti molli, subordinatamente ai rispettivi studi clinici”.
Sicurezza e tollerabilità
Lo studio clinico di fase 1 sarà condotto in Canada e prevede il reclutamento di un massimo di 48 e 32 volontari sani per le coorti, rispettivamente, a singola dose ascendente (SAD) e a multipla dose ascendente (MAD). L’obiettivo primario dello studio è la valutazione della sicurezza e tollerabilità di SAD e MAD di ALS-4 somministrato per via orale a soggetti sani, mentre quello secondario è la valutazione del profilo farmacocinetico di SAD e MAD di ALS-4 somministrato per via orale a soggetti sani.