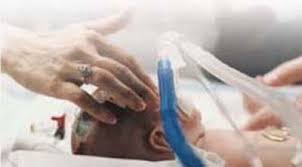
Airway Therapeutics, società biofarmaceutica incentrata sullo sviluppo di una nuova classe di farmaci biologici per spezzare il ciclo di lesioni e infiammazioni nei paziento con malattie respiratorie e infiammatorie, ha annunciato il lancio nel dicembre 2024 di un trial clinico multinazionale di fase 3 su zelpultide alfa (rhSP-D) per la prevenzione della displasia broncopolmonare (BPD) e la riduzione al minimo delle conseguenti lesioni polmonari nei neonati pretermine. Fino a 2,5 milioni di neonati molto pretermine a livello globale sono a rischio di sviluppare BPD dovuta a lesioni polmonari causate dalla ventilazione meccanica e dal supporto di ossigeno. La BPD può causare complicanze a vita come asma e polmonite, oltre a conseguenze sulla crescita e sullo sviluppo. Il trial pivotale verrà avviato in Italia e in Spagna, ampliandosi poi ad altri Paesi nel 2025. Lo studio randomizzato, in doppio cieco, a gruppi paralleli verrà condotto tra 316 neonati di età compresa tra le 23 e le 28 settimane per valutare l’efficacia di zelpultide alfa (somministrato per via intratracheale) in combinazione con lo standard terapeutico nella prevenzione o riduzione della gravità della BPD. “L’approvazione di questo trial di fase 3 si basa sul completamento riuscito del nostro studio randomizzato, in cieco, di fase 1b negli Stati Uniti e in Europa, nel quale non sono state identificate tossicità limitanti la dose in which no dose sono state osservate indicazioni di efficacia – ha dichiarato il presidente, Ceo e direttore medico di Airway, Marc Salzberg -. Zelpultide alfa sarebbe la prima terapia preventiva a proteggere i neonati dalla BPD, è una malattia polmonare debilitante”.
Airway Therapeutics lancerà un trial clinico di fase 3 su zelpultide alfa per i neonati pretermine a rischio di displasia broncopolmonare
da Luca Borghi | Ott 22, 2024 | Pharma | 0 commenti