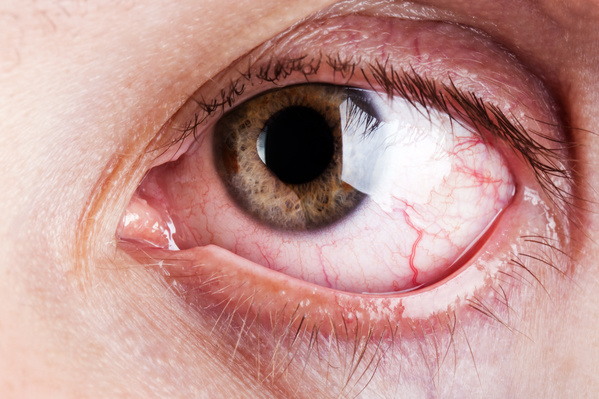
Novaliq, casa biofarmaceutica focalizzata su terapie oculari innovative e best in class basate sull’esclusiva tecnologia EyeSol senz’acqua, ha reso noto che la U.S. Food and Drug Administration (FDA) ha accettato la richiesta di nuovo farmaco (NDA) per CyclASol (soluzione oftalmica a base di ciclosporina), un innovativo antinfiammatorio per il trattamento di segni e sintomi della sindrome dell’occhio secco (DED). L’Agenzia ha completato l’analisi della NDA depositata per CyclASol determinando che la richiesta è sufficientemente completa da consentire un esame approfondito. Al momento non sono stati identificati potenziali problemi per la revisione. La data di attuazione del Prescription Drug User Fee Act (PDUFA) stabilita dalla FDA per l’annuncio della decisione sulla NDA di Novaliq dopo l’esame della richiesta è l’8 giugno 2023. “Si tratta di un momento entusiasmante per oftalmologi, optometristi e pazienti, perché ci avviciniamo a una risposta ad esigenze importanti e a un miglior trattamento di una grave patologia della superficie oculare che colpisce milioni di americani – ha commentato Christian Roesky, Ceo di Novaliq -. Se approvato, CyclASol rappresenterebbe una terapia antinfiammatoria estremamente potente, ma comoda, per i pazienti con sindrome dell’occhio secco. Mostra effetti terapeutici impressionanti e rapidi misurati oggettivamente sulla superficie oculare nella maggior parte dei pazienti, con benefici clinici per segni e sintomi della malattia”.
Cerca articoli
Articoli recenti
- Le patologie respiratorie ostruttive e restrittive e i disturbi respiratori nel sonno sono differenti nella donna e nell’uomo
- Studio sui genomi di Dante Labs mostra accelerazione dell’impatto della genomica sulla longevità
- Oltre 3.500 medici di medicina generale a congresso a Firenze per disegnare il futuro della sanità territoriale
- Dall’AI all’ottimizzazione energetica: Barilla e Plug and Play premiano le startup più innovative del food-tech
- Rigaku apre un laboratorio di bioscienze negli Stati Uniti