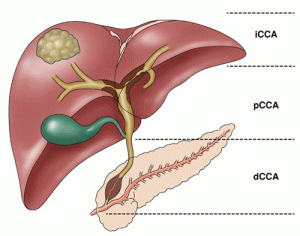
Incyte ha annunciato che il Comitato per i medicinali per uso umano (CHMP) dell’Agenzia europea per i medicinali (EMA) ha emesso un’opinione positiva, raccomandando l’autorizzazione all’immissione in commercio condizionale di pemigatinib per il trattamento di adulti con colangiocarcinoma non resecabile localmente avanzato o metastatico con fusione o riarrangiamento del recettore 2 del fattore di crescita dei fibroblasti (FGFR2), recidivante o refrattario dopo almeno una prima linea di terapia sistemica. Se approvato, pemigatinib sarà la prima terapia mirata nell’Unione europea per questa indicazione.
Cerca articoli
Articoli recenti
- Loreto Gesualdo presidente Fism: “Solo abituando i nostri giovani a uno stile di vita sano ed equilibrato, possiamo garantire un Ssn in grado di rispondere alle esigenze della popolazione”
- Malattie rare, da Uniamo e Respiriamo Insieme la Carta dei bisogni con patologie polmonari
- Cardiochirurghi, Michele Pilato è il nuovo presidente della Sicch
- Bambin Gesù e Istituto nazionale di fisica nucleare insieme per la ricerca e lo sviluppo di radiofarmaci oncologici
- Natale al castello di Varzi, con lo chef Alessandro Folli il gusto diventa magia della tradizione